8月医疗器械注册情况分析
据《医疗器械监督管理条例》规定,第Ⅱ、Ⅲ类医疗器械采用产品注册管理方式。
境内第二类医疗器械由省、自治区、直辖市药监局审查,批准后发给医疗器械注册证。
境内第三类医疗器械由国家药监局审查,批准后发给医疗器械注册证。
进口第二类、第三类医疗器械由国家药监局审查,批准后发给医疗器械注册证。香港、澳门、台湾地区医疗器械的注册、备案,参照进口医疗器械办理。
2023年8月注册备案信息汇总统计:
本月注册批准医疗器械数量1298项
本月备案批准医疗器械数量1518项
本月优先审批注册医疗器械产品5项
本月创新审批注册医疗器械产品14项
据药智医械数据最新统计,2023年8月NMPA共批准注册医疗器械1298项,同比增加16.9%,其中优先审批注册5项,创新审批注册14项;审批备案医疗器械数量1518项,同比减少1.6%。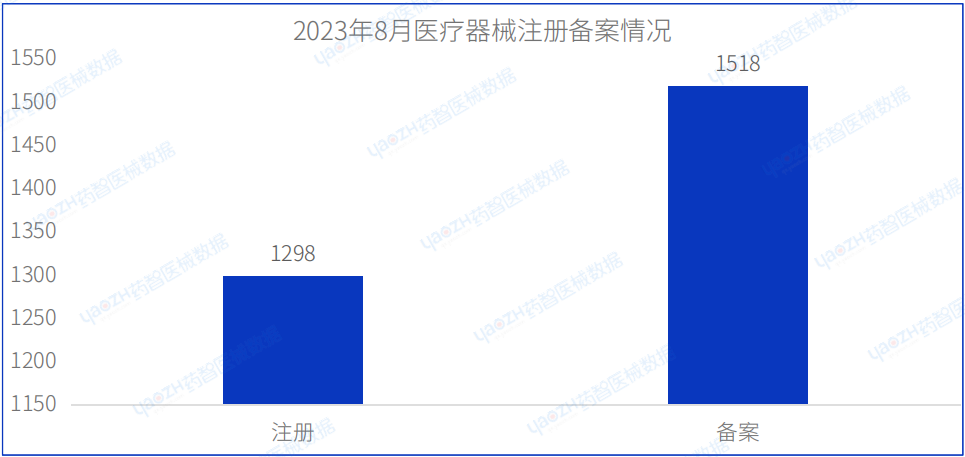
2023年8月,国家药品监督管理局共批准注册医疗器械产品1298项。其中,国产第Ⅱ类医疗器械产品1036项,国产第Ⅲ类医疗器械产品203项,进口第Ⅱ类医疗器械产品23项,进口第Ⅲ类医疗器械产品36项,国产占比95.4%。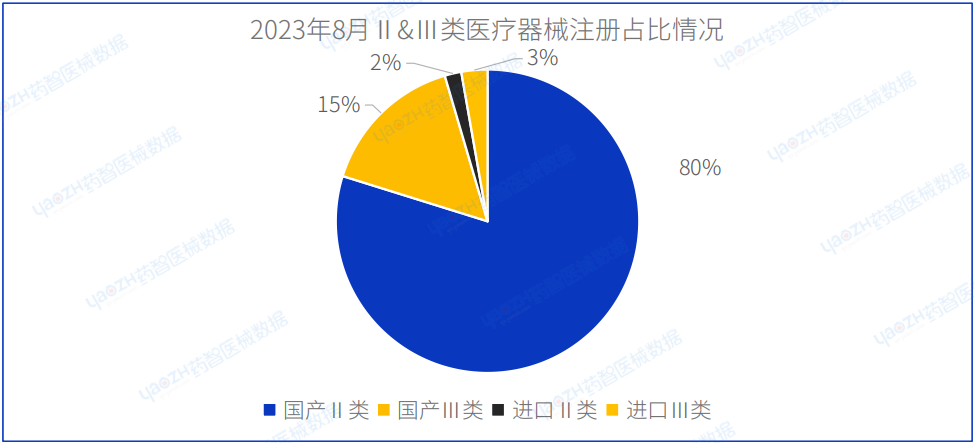
从产品类别来看,2023年8月注册医疗器械中,体外诊断试剂(376件),注输、护理和防护器械(238件)、及口腔科器械(107件)注册数量排名前三。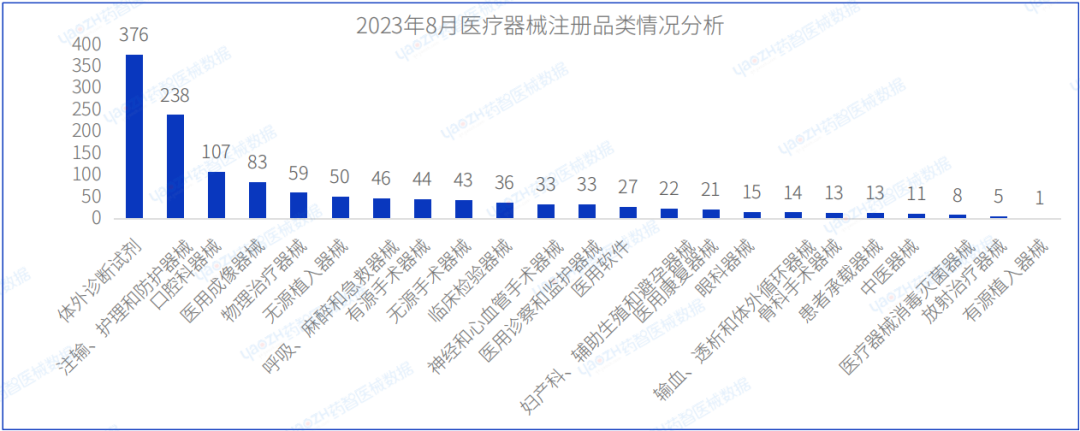
2023年7月-8月,医用防护口罩等防护类医疗器械和义齿类口腔科医疗器械依旧占据医疗器械注册产品数量排名前几位的位置。此外,8月口腔科医疗器械产品注册数量较7月明显增加。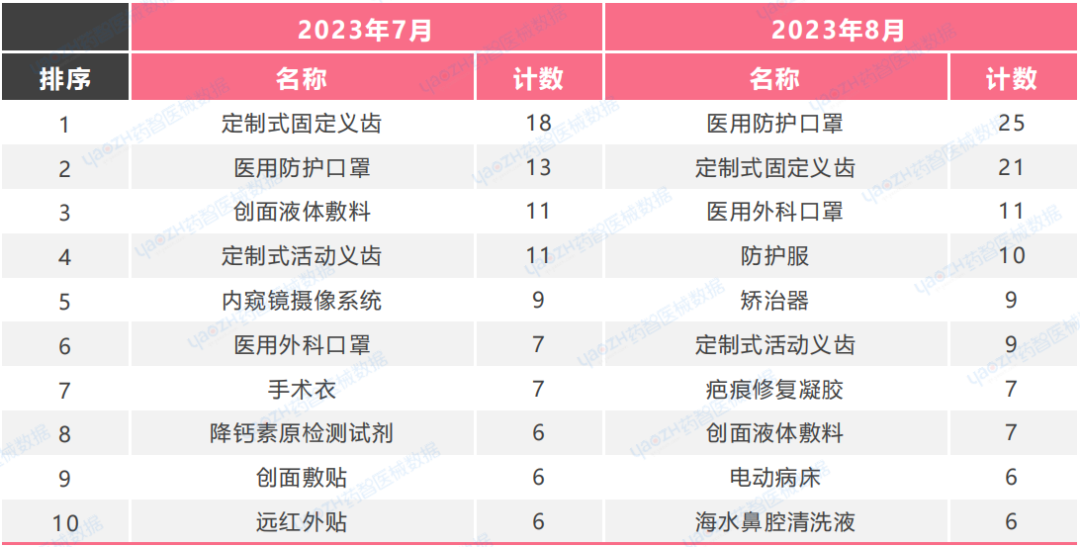
从Ⅱ类医疗器械注册产品来源地分布来看,国内8月共有23个省市(不包括中国港澳台)注册Ⅱ类医疗器械,其中江苏省注册医疗器械数量最多,占国产Ⅱ类医疗器械注册数量的19.4%。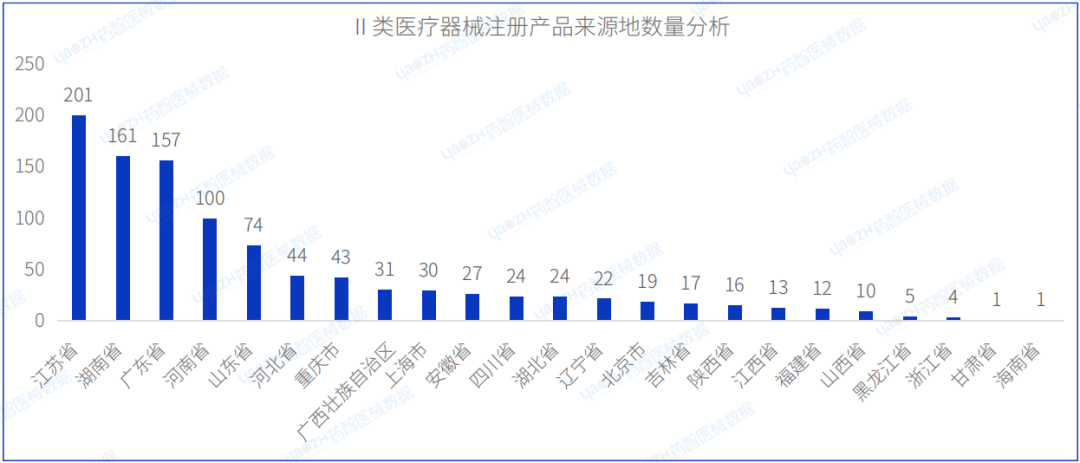
从Ⅲ类医疗器械注册产品来源地分布来看,国内8月共有17个省市(不包括中国港澳台)注册Ⅲ类医疗器械,其中江苏省注册医疗器械数量最多,占国产Ⅲ类医疗器械注册数量的23.1%。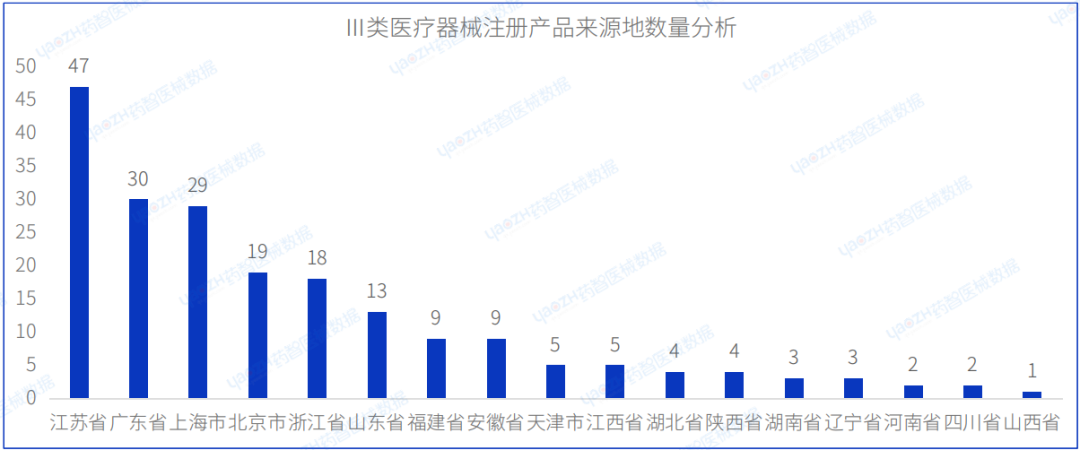
据《医疗器械监督管理条例》规定,第一类医疗器械采用产品备案管理方式。
2023年8月国产Ⅰ类医疗器械备案批准数量1490项,同比减少1.3%。同时,进口第一类医疗器械备案批准数量28项,同比减少15.1%。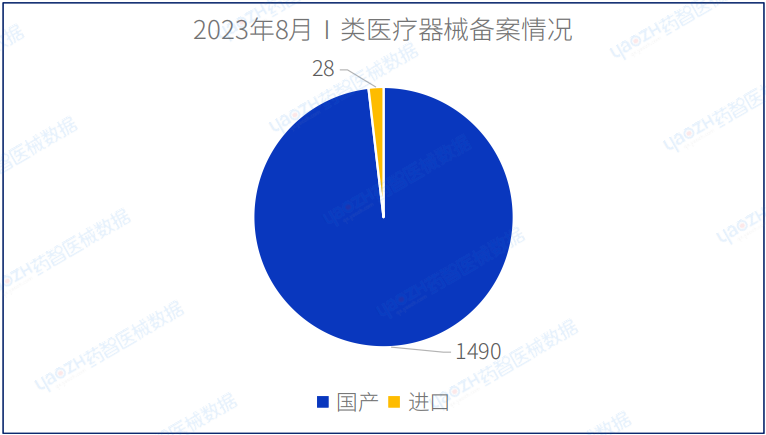
8月医疗器械创新及优先审批
根据《创新医疗器械特别审批程序(试行)》,我国医疗器械创新审批是为了保障医疗器械的安全、有效,鼓励医疗器械的研究与创新,促进医疗器械新技术的推广和应用,推动医疗器械产业发展的特殊审批通道。
2023年8月,全国创新审批注册产品共计14项,均为国产注册产品。
从产品类别来看:包括12项器械产品,2项试剂产品。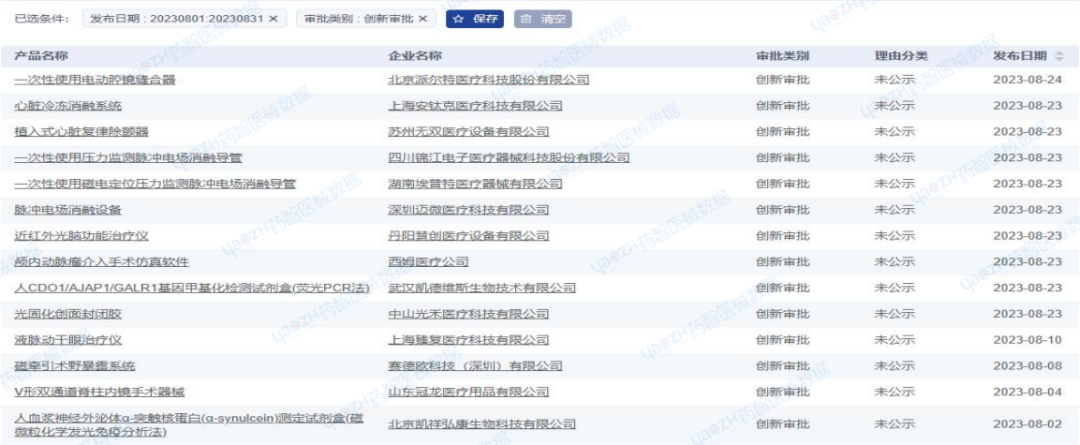
2023年8月共有8个省市注册创新审批医疗器械,其中江苏省、广东省注册数量排名并列第一,均为3项。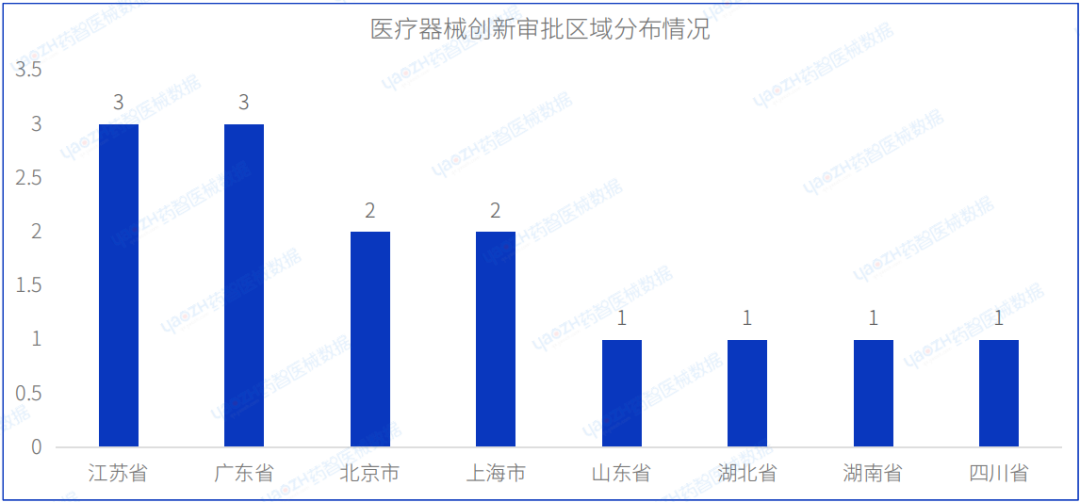
2016年10月25日,国家药监局发布《医疗器械优先审批程序》,于2017年1月1日起施行。根据《医疗器械优先审批程序》,对下列医疗器械实施优先审批:
一是诊断或治疗罕见病、恶性肿瘤且具有明显临床优势的医疗器械,诊断或治疗老年人特有和多发疾病且尚无有效诊断或治疗手段的医疗器械,专用于儿童且具有明显临床优势的医疗器械;
二是列入国家科技重大专项或国家重点研发计划的医疗器械。
此外,将根据各方面情况和意见,组织专家审查后,确定对“其他应当优先审批的医疗器械”予以优先审批。
2023年8月,全国优先审批注册产品共计5项,均为国产产品。从产品类别来看:均为器械产品,无试剂产品。
2023年8月共有4个省市注册医疗器械进入优先审批,其中重庆市注册数量排名第一。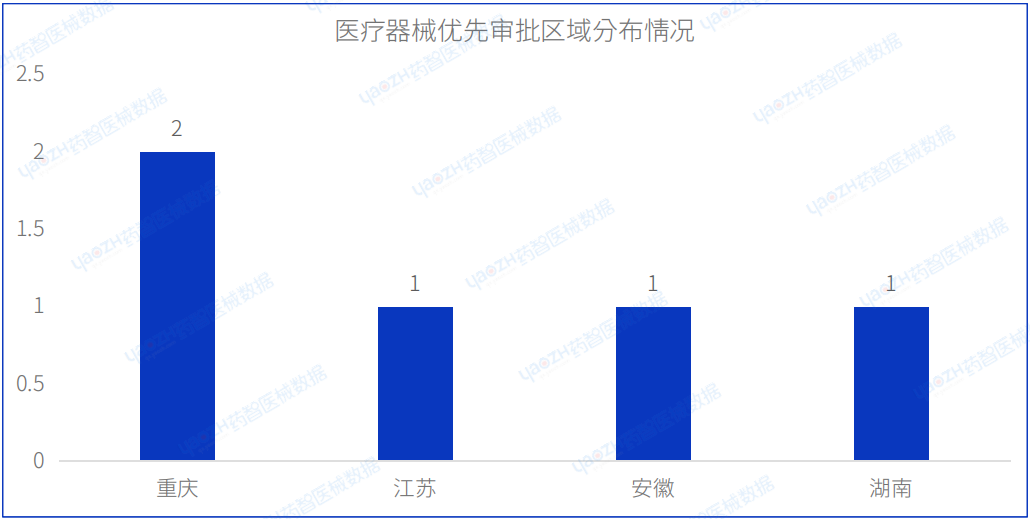
8月医疗器械注册企业分析
2023年8月国内注册医疗器械企业达791家。排行前十的企业中,排名前三的分别是:中秀科技股份有限公司、长沙市鹏瑞生物科技有限公司、凡镜生物科技(山东)有限公司,其中中秀科技股份有限公司的注册数量排名第一,排行前十的企业情况如下图所示。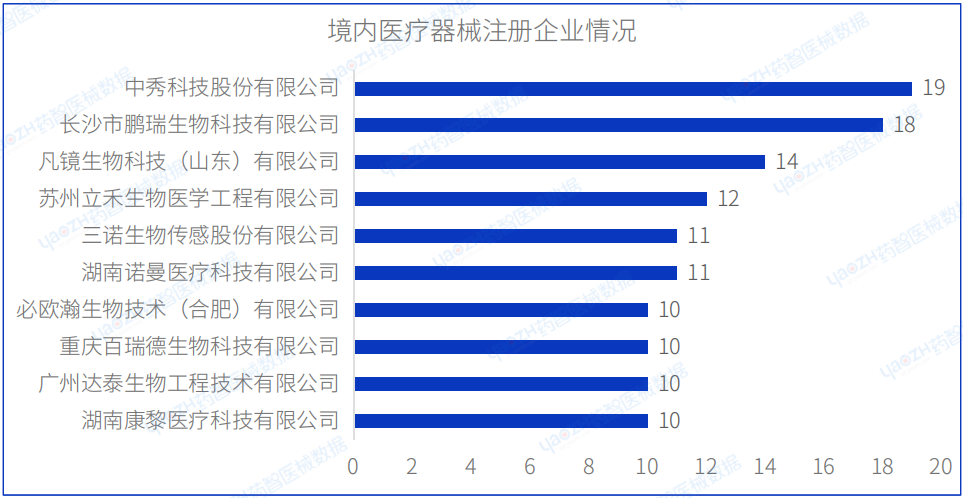
2023年8月,中秀科技股份有限公司在江苏省药监局完成19项医疗器械注册,注册产品数量排名第一,均为Ⅱ类IVD诊断试剂产品。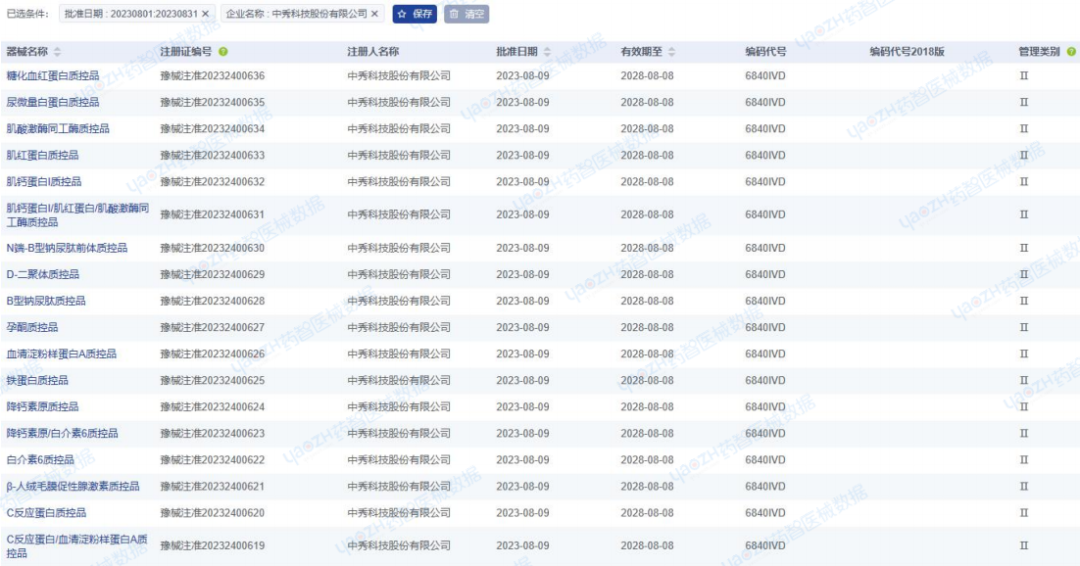
注:截图仅为部分产品数据,完整信息请前往药智医械数据-中国上市医疗器械数据库检索查看
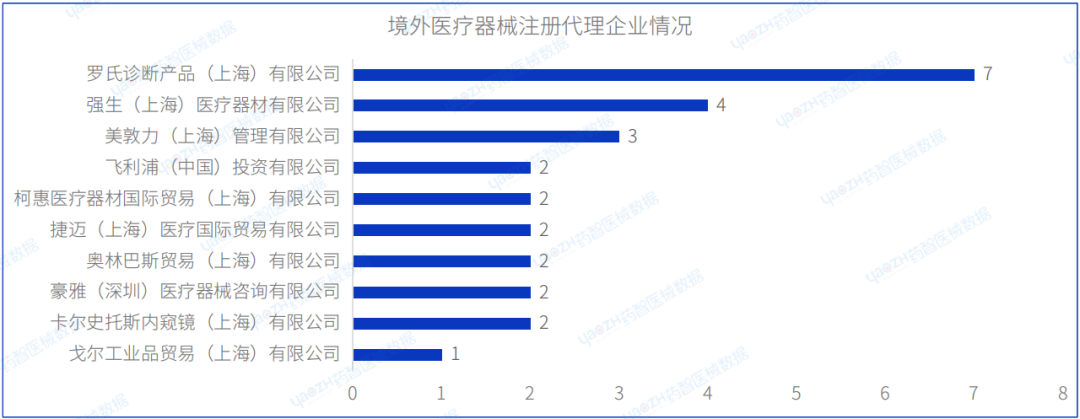
从进口医疗器械代理人企业情况看,2023年8月进口医疗器械注册代理人企业达42家。排行前十的企业中,排名前三的分别是:罗氏诊断产品(上海)有限公司、强生(上海)医疗器材有限公司、美敦力(上海)管理有限公司,其中罗氏诊断产品(上海)有限公司的注册数量排名第一,排行前十的企业情况如下图所示。